Nikotinamid adenin dinukleotid (NAD+) je kofaktor – molekula, ki pomaga encimom pri kemičnih reakcijah – in ima ključno vlogo pri številnih fizioloških procesih, kot so energijski metabolizem, popravljanje DNK in imunska aktivacija. Ključnega pomena je za aktivnost sirtuinov, razreda encimov, ki sodelujejo pri dolgoživosti, in poli ADP-riboza polimeraze (PARP), družine encimov, ki popravljajo DNK. Celična proizvodnja NAD+ s starostjo upada, izčrpavanje zalog pa vpliva na nastanek in napredovanje s starostjo povezanih bolezni, kot so motnje v presnovi in nevrodegenerativne bolezni.
NAD+ se lahko v telesu sintetizira iz različnih prehranskih virov, vključno s triptofanom (aminokislina) in tremi oblikami niacina (vitamin B3) – nikotinamidom (NAM, imenovan tudi niacinamid), nikotinsko kislino (NA) in nikotinamidnim ribozidom (NR) – ti so običajno imenovani niacinski ekvivalenti. [1] Od teh treh je NA glavni vir NAD+. Ti predhodniki niso enakomerno razporejeni po telesu, temveč so prednostno porazdeljeni in jih tako najdemo v krvi, možganih, črevesju in drugih organih.
Niacin najdemo v različnih živilih, vključno s fižolom, mlekom, mesom in jajci. Nikotinamid mononukleotid (NMN), še en prehranski predhodnik NAD+, lahko najdemo tudi v različnih živilih, kot so brokoli, avokado in goveje meso.[2] Številne študije na živalih in ljudeh so pokazale, da je povečanje NAD+, ki ga izvedemo bodisi s prehranskim vnosom njegovega predhodnika ali z neposrednim uživanjem dopolnil, koristno pri preprečevanju ali odpravi bolezni, povezanih s staranjem.[3]
NMN
Biosinteza in recikliranje
Prevladujoči vir NAD+ v telesu je reciklažna pot NAD+. Deloma je to zato, ker encimi, kot so sirtuini in PARP, porabljajo molekule NAD+, ki izčrpavajo zaloge na celični ravni in kot stranski produkt tvorijo nikotinamid (niacinski ekvivalent). Reciklažna pot pretvori nikotinamid v nikotinamid mononukleotid (NMN) preko encima nikotinamid fosforibosiltransferaza (NAMPT). Po izvedbi nekaj drugih korakov se NMN sčasoma pretvori v NAD+.[4] Pomembno je opozoriti, da je za ta encim podvržen inhibicijam s povratno zvezo NAD+, kar pomeni, da ko je določena raven NAD+ dosežena, reciklažna pot preneha proizvajati NAD+.
NMN
Energijski senzor
NAD+ je kritičen za ustvarjanje energije v celicah. V mitohondrijih je NAD+ kofaktor pri presnovi encimov, ki sodelujejo v oksidativni fosforilaciji, procesu, v katerem se energija proizvaja v obliki ATP s prenosom elektronov iz nosilcev elektronov, kot je NAD+, na kisik. Izven mitohondrijev je NAD+ kofaktor za encime, ki sodelujejo v glikolizi – proizvodnji energije v obliki ATP iz glukoze.[5]
Kadar je raven celične energije nizka, na primer med vadbo, postom ali zaradi kalorične restrikcije, se raven celic NAD+ poveča, razmerje reducirane oblike NAD+, NADH, pa se poveča in s tem služi kot “senzor” za vklop poti, ki ustvarjajo energijo in aktiviranje encimov, kot so sirtuini. [6] Nasprotno pa lahko izčrpavanje zalog NAD+ zaradi poškodbe ali staranja DNK povzroči zaviranje tvorbe ATP, ki je odvisna od NAD+, in hudo pomanjkanje celične energije.
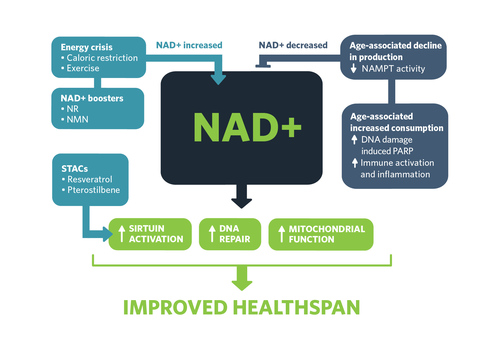
Upad NAD+ s staranjem in možnost posredovanja. NAD+ omogoča aktivacijo sirtuinov, popravljanje DNK in delovanje mitohondrijev, kar zagotavlja trdno zdravje.
Status NAD+ pri staranju in možnost posredovanja. Celične ravni NAD+ naraščajo zaradi energijskega stresa, kot sta kalorična restrikcija ali vadba; s pomočjo dopolnil z NAD+, NR in NMN, ki “pospešujejo” sintezo; ali preko sirtuin-aktivirajočih spojin (STAC-ov), kot sta resveratrol ali pterostilben. Ravni NAD+ se s staranjem zmanjšujejo zaradi povečane aktivnosti NAMPT, pa tudi zaradi s staranjem povezanih celičnih potreb po popravilu DNK, ki jih usmerja PARP, funkciji imunskega sistema in vnetij.
NMN
Staranje
Izčrpavanje zalog NAD+ je povezano z značilnostmi staranja, kot so zmanjšana sposobnost avtofagije, povečana poškodba DNK, povečana disfunkcija v delovanju mitohondrijev in disregulirano zaznavanje hranil.[3] Izčrpavanje zalog NAD+ lahko naredi organizem dovzeten za razvoj različnih s starostjo povezanih bolezni, vključno z nevrodegenerativnimi boleznimi, presnovnimi boleznimi in rakom.[7] Dokazali so, da se ravni NAD+ s starostjo pri več vrstah, tudi pri ljudeh, zmanjšujejo.[8] [9] [10]
V nasprotju s tem se raven NAD+ poveča v skladu s stvarmi, ki spodbujajo krepitev posameznikovega zdravja ali podaljšanje življenjske dobe, kot sta telesna vadba ali kalorična restrikcija.[6] [11] Poleg tega se znanstveniki ugotovili, da obnovitev NAD+ povečuje življenjsko dobo nižjih življenjskih oblik, kot so kvasovke in črvi ter glodalci.[12] [13] Pri mišjem modelu z Alzheimerjevo boleznijo je povečanje NAD+ preko predhodnikov NR ali NMN izboljšalo motnje v delovanju mitohondrijev, zavrlo smrt nevronskih celic in s tem upočasnilo kognitivni upad.[14] [15]
Skupaj te ugotovitve kažejo, da ima NAD+ kritično vlogo pri staranju. Zdi se, da je zmanjšanje ravni NAD+, ki ga običajno opazimo pri staranju, kombinacija zmanjšane sinteze, povečane porabe in povečane razgradnje.[16] Izčrpavanje NAD+ lahko povzroči nepopravljeno poškodbo DNK, saj ta za delovanje PARP-1 potrebuje NAD+. Poleg tega celice imunskega sistema, ki se aktivirajo ob poškodbah in vnetju, porabijo veliko energije in tako izčrpavajo zaloge NAD+. Zato lahko večina poškodb DNK in vnetij, ki so običajna posledica staranja, zmanjšajo raven NAD+ in stopnjujejo procese staranja.[17]
NMN
Fiziološki odzivi NAD+
NAD+ je vključen v številne fiziološke procese, kot so popravljanje DNK, uravnavanje vnetij, avtofagija in energijski metabolizem, ki ima pomembno vlogo pri uravnavanju zdravja in staranja.
NMN
NMN
Poškodbe DNK & popravilo DNK
Ko se organizmi starajo, lahko povečano število poškodb DNK stopnjuje procese staranja in razvoj starostnih bolezni. Encimi PARP so tisti, ki zaznajo poškodbe DNK in sprožijo popravilo s signalizacijo drugih encimov, ki popravljajo DNK. Na ta način PARP po vsej verjetnosti pozitivno vpliva na dolgoživost, saj je aktivnost PARP v belih krvničkah več vrst sesalcev zanesljih napovedovalec najvišje možne življenjske dobe.[18] Poleg tega so izsledki študije, v kateri je bila aktivnost PARP-1 izmerjena na več vrstah sesalcev, pokazali, da višja kot je aktivnost PARP-1, daljša je življenjska doba.[19] Razlika v aktivnosti PARP-1 med testiranimi sesalci z najdaljšo življenjsko dobo (t.j. človek) in tistimi z najkrajšo življenjsko dobo (podgane) je bila 5-kratna. Presenetljivo je, da je raziskava, v kateri so bile uporabljene celične linije starostnikov (ljudi, starejših od 100 let), pokazala, da je bila aktivnost celic PARP znatno višja od tiste v celičnih linijah pri veliko mlajših odraslih.[20] Aktivnost PARP-1 so povezali tudi z najdaljšo življenjsko dobo pri sesalcih.
Koža je še posebej občutljiva na posledice staranja. Študija, ki je pregledala vzorce človeške kože pri 49 ljudeh, starih med 15 in 77 let, je pokazala, da se je s starostjo aktivnost PARP-1 povečala, ravni NAD+ pa so se zmanjšale.[21] Pokazalo se je tudi, da čezmerna poškodba DNK znižuje NAD+ na 20 do 30 odstotkov njegove normalne ravni.[22] [23] S staranjem je poškodb DNK vedno več, naše celice pa povečujejo povpraševanje po njegovem popravilu. Kronično znižanje ravni NAD+ lahko sčasoma privede do izčrpavanja zalog NAD+. Pretirano delovanje PARP-1 in kasnejša poraba NAD+ lahko omejita aktivnost drugih encimov, ki porabljajo NAD+, npr. sirtuinov.[24]
NMN
Povečanje zaloge NAD+ vpliva na aktivnost sirtuinov
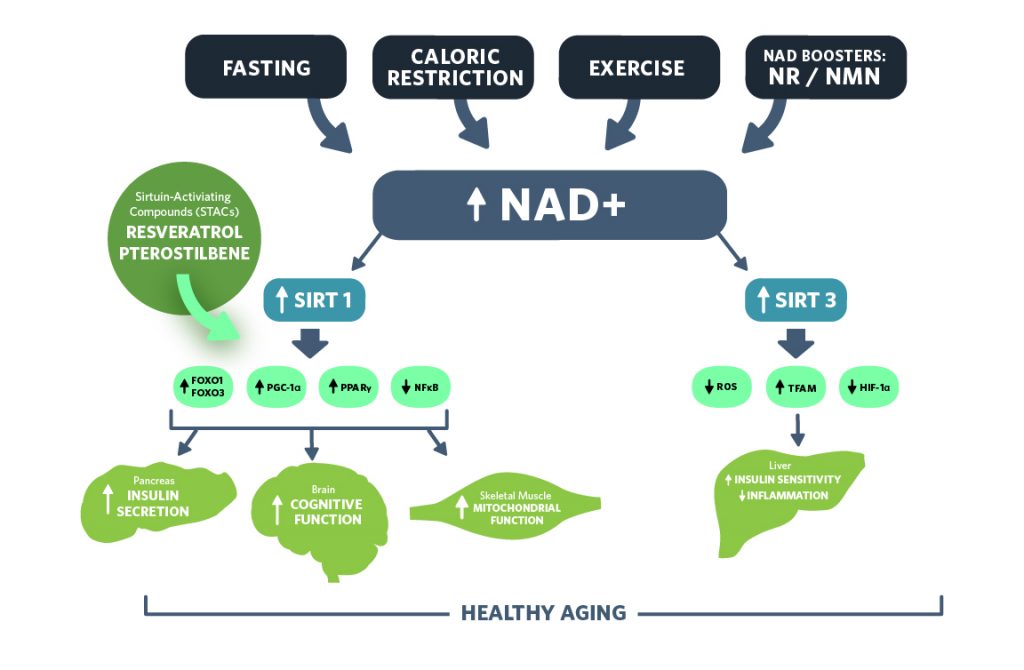
Povečanje zaloge NAD+ spodbuja aktivnost sirtuinov. Aktivacija SIRT1 vodi do izboljšanega delovanja inzulina v jetrih, izboljšanih kognitivnih funkcij v možganih in povečane mitohondrijske biogeneze v skeletnih mišicah. Aktivacija SIRT3 vodi do izboljšane občutljivosti na inzulin in zmanjšuje vnetja v jetrih. Izguba aktivnosti sirtuinov med staranjem je povezana s spremenjenim statusom NAD+.[4]
NMN
Aktivacija sirtuinov
NAD+ deluje kot substrat za beljakovine sirtuine, družino encimov, ki sodelujejo v različnih presnovnih procesih. Sirtuini uporabljajo NAD+ za odstranjevanje specifičnih kemičnih struktur, imenovanih acetilne skupine – proces, imenovan deacetilacija – iz celičnih beljakovin; s tem nadzorujejo transkripcijske regulacije, energijski metabolizeme, cirkadiani ritem, popravljanje DNK in preživetje celic. Kot je opisano zgoraj, se razmerje reduciranega NAD+, iz katerega nastane NADH, poveča, če so izpolnjeni pogoji nizke celične energije, kar aktivira izražanje in aktivnost sirtuinov. Sirtuini se morajo odzvati na dinamične spremembe NAD+, da sprožijo ustrezne prilagoditvene odzive. Aktivnost sirtuinov, ki je potencialno lahko posledica zmanjšanja NAD+, se običajno zmanjša pri staranju in številni živalski modeli kažejo, da lahko zmanjšana aktivnost SIRT1 spodbuja nastanek in razvoj srčno-žilnih in nevroloških bolezni. [25] [26]
NMN
NMN
Funkcija mitohondrijev
Mitohondrije klasično obravnavamo kot elektrarno celice, ker ustvarjajo energijo v obliki ATP. Prav tako so izjemnega pomena pri celičnem metabolizmu in delovanju signalnih poti. Motnje v delovanju mitohondrijev so znak, da se je proces staranja pričel in lahko privedejo do zmanjšanja proizvodnje energije, motenj v celičnem metabolizmu in napredovanju starostnih bolezni. Vzdrževanje mitohondrijev z mitofagijo (selektivno razgradnjo okvarjenih mitohondrijev) in biogenezo mitohondrijev (sintezo novih mitohondrijev) je ključnega pomena za ohranjanje celične homeostaze in zdravja.[27]
NAD+ se je izkazal kot pomemben regulator vzdrževanja mitohondrijev. Izkazalo se je, da porast NAD+ zaradi posta sproži biogenezo mitohondrijev.[28] Poleg tega lahko zvišanje ravni NAD+ pri starih miših obnovijo funkcijo njihovih mitohondrijev na raven, ki je značilna za mlade miši.[29]
NMN
Cirkadiani ritem
Cirkadiani sistem, sestavljen iz več “notranjih celičnih ur”, ki jih najdemo v vseh celicah po telesu, uravnava regulacijo izražanja genov; ti usklajujejo presnovne programe, potrebne za podporo telesnih funkcij. Nivoji NAD+ imajo 24-urni celični ciklus, uravnavata pa jih osnovna gena clock CLOCK in BMAL1.[30] Ta gena uravnavata cirkadiano izražanje NAMPT, encima v reciklažni poti NAD+.[31] Poleg tega lahko NAD+ neposredno uravnava cirkadiani ritem z aktiviranjem sirtuinov. [32] [33] Tako NAD+ močno sodeluje pri regulaciji cirkadiane ure, ki ob pravilnem delovanju pomaga ohranjati homeostazo in zdravje.
NMN
Energijski metabolizem
NAD+ igra ključno vlogo pri energijskem metabolizmu s sprejemanjem in darovanjem elektronov skozi postopke redukcije in oksidacije, ki jih imenujemo redoks reakcije. Te izmenične pretvorbe oksidirane oblike NAD+ v reducirano obliko (NADH) igrajo pomembno vlogo pri reakcijah, povezanih s presnovo glukoze in maščobnih kislin in tvorbo ATP. Ker sta oksidirana in reducirana oblika NAD+ bistvenega pomena za te povezane sklope reakcij, celice ohranjajo pomembne koncentracije tako NAD+ kot NADH. Brez NAD+ in z njim povezanih molekul bi življenje prenehalo obstajati. [34]
NMN
NAD+ boosterji in prehranski dodatki
Pokazalo se je, da zvišana raven NAD+ izboljšuje življenjsko dobo in podaljšuje zdravje pri živalskih modelih, ki trpijo za prezgodnjim staranjem, kar je spodbudilo nadaljnje raziskave v zvezi z dodajanjem NAD+ pri ljudeh z namenom zdravljenja in preprečevanje starostnih bolezni.[7] Znanstveniki so natančno raziskali zlasti dva ključna predhodnika NAD+, nikotinamid ribozid (NR) in nikotinamid mononukleotid (NMN) in ugotovili, da pri živalih izboljšujeta stanja, ki nastanejo zaradi s staranjem povezanih bolezni. Pokazalo se je, da glodalci dobro prenašajo NR in NMN ter da oba pomagata učinkovito zviševati ravni NAD+ pri glodalcih. Trenutno je dokazano, da NR poviša plazemske vrednosti NAD+ in lahko koristno vpliva na človekovo zdravje.[35][36] Na splošno pa celice ne prejemajo neposredno NAD+, potrebne pa so tudi študije o učinkovitosti in varnosti dopolnjevanja NAD+ s pomočjo intravenozne infuzije.
NAD+ ima slabo biološko uporabnost. Študije na živalih so pokazale, da se po zaužitju NAD+ razgradi na svoj predhodnik nikotinamid, pa tudi na NR in NMN, preden se absorbira.[37] Medtem ko je biološka uporabnost NAD+ nizka, če je ta odmerjen peroralno, je možno, da se v izogib obremenjevanju prebavnega sistema uporabi intravenozna infuzija NAD+. Na žalost pri sesalcih niso odkrili nobenega prenašalca NAD+, z izjemo možganov in srca pa ni bilo dokazano, da se zunajcelični NAD+ prenaša v tkiva. Na primer, NAD+, odmerjen z intraperitonealno injekcijo (t.j. injekcija, ki se vnese v trebušno votlino), je v nekaterih možganskih regijah pri miših povečal raven NAD+.[38] Podobno so miši, ki so jim injicirali velik odmerek NAD+, imele povečano raven tega v srcu in so bile bolj zaščitene pred srčno hipertrofijo (zadebeljenjem srčne mišice).[39] Študije in vitro so pokazale tudi, da bi nekatere vrste celic lahko prevažale zunajcelični NAD+ skozi plazemsko membrano. [40]
Nedavna pilotna študija pri ljudeh je raziskovala spremembe v ravni NAD+ v plazmi in urinu in njihovih presnovkov med infuzijo NAD+. V raziskavi je sodelovalo 11 zdravih moških, starih med 30 in 55 let, ki so v roku šestih ur prejeli 750 miligramov NAD+ z intravensko infuzijo. Po prvih dveh urah infuzije sprememb NAD+ ali njegovih presnovkov (kot so nikotinamid, metilnicotinamid ali adenozin-fosfatna riboza) ni bilo mogoče zaznati, kar kaže na to, da je bil dodani NAD+ popolnoma odstranjen iz plazme in ga verjetno absorbirajo tkiva. Po dveh urah prejemanja infuzije pa so v plazmi odkrili NAD+ in njegove presnovke pri ravneh, ki so približno 400 odstotkov nad izhodiščnimi vrednostmi, kar lahko potrjuje, da je bila nasičenost tkiva dosežena.[41] Medtem ko je ta študija prvič razkrila potencialno usodo eksogenega intravenskega NAD+ pri ljudeh, so za določitev natančne presnovne usode dodanega NAD+ preko infuzije potrebne nadaljnje študije.
NMN
Nikotinamid ribozid / nikotinamid mononukleotid
Ravni NAD+ v telesnih tkivih nihajo glede na celično porabo in razpoložljivost prekurzorja ali substrata. Največje nihanje se pojavi v tankem črevesju in vranici, najmanjše pa v skeletnih mišicah.
V prvi študiji so uporabili sledove izotopov za sledenje toku NAD+ pri miših glede na izvor.[42] Ko je bil vir izotopov peroralni triptofan, je bil NAD+ proizveden v jetrih za lokalno uporabo, kjer se je razgradil na nikotinamid, kot je opisano zgoraj. Nikotinamid je bil nato izvožen v druga tkiva, kot so mišice, možgani in črevesje, ki so uporabili reciklažne poti, da so ga pretvorili nazaj v NAD+.
Avtorji študije so preučevali, ali bi se peroralno zaužita NR in NMN izvažala v druga tkiva, kjer bi nato neposredno tvorila NAD+ in se tako izognila inhibiciji s povratno zvezo NAMPT. S pomočjo sledilcev izotopov, ki so jim omogočali razlikovanje med NAD+ (ki je narejen neposredno iz NR ali NMN) in NAD (ki je narejen iz nikotinamida, NR ali NMN), so ugotovili, da je nizek peroralni odmerek prekurzorjev (50 miligramov na kilogram telesne teže) povzročil zelo nizko raven NAD+, ki nastaja neposredno iz NR in NMN v jetrih, ne pa tudi v drugih tkivih. Po drugi strani so bile odkrite tudi nizke ravni NAD+, ki izvirajo iz nikotinamida, v ledvicah, mišicah in možganih, ki so nastale iz recikliranega nikotinamida v NR in NMN.
Višji peroralni odmerek NR (200 mg na kilogram telesne teže) ni pokazal nobene razlike v primerjavi z nizkim odmerkom pri neposredni proizvodnji NAD+ v drugih tkivih razen v jetrih. Vendar pa je bilo več NAD+ pridobljenega iz nikotinamida, najdenega v ledvicah, mišicah in možganih pri nižjem odmerku 50 mg/kg telesne teže.
Ko sta bila NR in NMN dana intravensko v različnih odmerkih (50 mg/kg telesne teže in 500 mg kg telesne teže), so znanstveniki neposredno proizvedeni NAD+ našli v jetrih, ledvicah in mišicah, odvisno od odmerka. Vendar je bil edini NAD+, ki je bil odkrit v možganih, tisti, ki je bil recikliran iz nikotinamida, kar kaže na to, da niti NR niti NMN ne prečkata krvno-možganske pregrade. Treba je opozoriti, da so enaki vbrizgani odmerki NR in NMN ustvarili več NAD+, ki je bil proizveden neposredno iz NR v jetrih, ledvicah in zlasti v mišicah v primerjavi z NMN.
NMN
NADH kot vir celičnega NAD+
Reducirana oblika nikotinamid adenin dinukleotida (NADH) ima pomembno vlogo pri reakcijah, povezanih s presnovo glukoze in maščobnih kislin in tvorbo ATP. Malo raziskav je bilo izvedenih, s katerimi bi preverili, ali lahko dopolnjevanje z NADH poveča ravni NAD+; vendar so NADH raziskovali kot možno komponento za zdravljenje za Alzheimerjeve bolezni. V študiji 25 ljudi, ki so bili diagnosticirani z blago do zmerno demenco, dodajanje 10 miligramov NADH, ki so ga peroralno jemali tri mesece, ni pokazalo nobenega kognitivnega izboljšanja med udeleženci študije.[43] V ločeni študiji pa je 12 bolnikov z diagnozo Alzheimerjeve bolezni šest mesecev prejemalo 10 miligramov NADH dnevno. Ob koncu študije se je pri bolnikih, ki so prejemali NADH, izkazalo, da so se na Mattisovi lestvici demence odrezali boljše kakor prej, saj je bil njihov govor bolj tekoč, izboljšale pa so se jim tudi vidne konstrukcijske sposobnosti in abstraktno verbalno sklepanje. Čeprav se zdijo ugotovitve teh raziskav protislovne, je mogoče, da je trajanje testiranj vplivalo na rezultate. Kljub temu pa je potrebnih več raziskav, s katerimi bo moč ugotoviti, ali NADH poveča celični NAD+ in ali ga je mogoče uporabiti za izboljšanje simptomov, povezanih z Alzheimerjevo boleznijo.[44]
NMN
Zaključek
NAD+ je odgovoren za več fizioloških procesov, kot so energetski metabolizem, popravljanje DNK in imunsko aktivacijo. Brez NAD+ bi življenje prenehalo obstajati. S starostjo raven NAD+ upada, kar je povezano z napredovanjem staranja in s starostjo povezanih bolezni. Dokazano je, da dviganje ravni NAD+ izboljšuje življenjsko dobo in zdravje pri več modelih živali, pa tudi izboljšuje starostne bolezni pri ljudeh.
NMN
NMN
Viri:
- ^ Johnson, Sean, and Shin ichiro Imai. NADthplus biosynthesis, aging, and disease F1000Research 7 (February 2018): 132. https://doi.org/10.12688/f1000research.12120.1.
- ^ Mills, Kathryn F., Shohei Yoshida, Liana R. Stein, Alessia Grozio, Shunsuke Kubota, Yo Sasaki, Philip Redpath, et al. Long-Term Administration of Nicotinamide Mononucleotide Mitigates Age-Associated Physiological Decline in Mice Cell Metabolism 24, no. 6 (December 2016): 795–806. https://doi.org/10.1016/j.cmet.2016.09.013.
- ^ a b Fang, Evandro F., Sofie Lautrup, Yujun Hou, Tyler G. Demarest, Deborah L. Croteau, Mark P. Mattson, and Vilhelm A. Bohr. NAD thplus in Aging: Molecular Mechanisms and Translational Implications Trends in Molecular Medicine 23, no. 10 (October 2017): 899–916. https://doi.org/10.1016/j.molmed.2017.08.001.
- ^ a b Verdin, E. NADthplus in aging, metabolism, and neurodegeneration Science 350, no. 6265 (December 2015): 1208–13. https://doi.org/10.1126/science.aac4854.
- ^ Cantó, Carles, Keir J. Menzies, and Johan Auwerx. NADthplus Metabolism and the Control of Energy Homeostasis: A Balancing Act between Mitochondria and the Nucleus Cell Metabolism 22, no. 1 (July 2015): 31–53. https://doi.org/10.1016/j.cmet.2015.05.023.
- ^ a b Costford, Sheila R., Sudip Bajpeyi, Magdalena Pasarica, Diana C. Albarado, Shantele C. Thomas, Hui Xie, Timothy S. Church, Sharon A. Jubrias, Kevin E. Conley, and Steven R. Smith. Skeletal muscle NAMPT is induced by exercise in humans American Journal of Physiology-Endocrinology and Metabolism 298, no. 1 (January 2010): E117–E126. https://doi.org/10.1152/ajpendo.00318.2009.
- ^ a b Rajman, Luis, Karolina Chwalek, and David A. Sinclair. Therapeutic Potential of NAD-Boosting Molecules: The In Vivo Evidence Cell Metabolism 27, no. 3 (March 2018): 529–47. https://doi.org/10.1016/j.cmet.2018.02.011.
- ^ Braidy, Nady, Gilles J. Guillemin, Hussein Mansour, Tailoi Chan-Ling, Anne Poljak, and Ross Grant. Age Related Changes in NADthplus Metabolism Oxidative Stress and Sirt1 Activity in Wistar Rats PLoS ONE Edited by Aimin Xu. 6, no. 4 (April 2011): e19194. https://doi.org/10.1371/journal.pone.0019194.
- ^ Ramsey, Kathryn Moynihan, Kathryn F. Mills, Akiko Satoh, and Shin-ichiro Imai. Age-associated loss of Sirt1-mediated enhancement of glucose-stimulated insulin secretion in beta cell-specific Sirt1-overexpressing (BESTO) mice Aging Cell 7, no. 1 (February 2008): 78–88. https://doi.org/10.1111/j.1474-9726.2007.00355.x.
- ^ Zhu, Xiao-Hong, Ming Lu, Byeong-Yeul Lee, Kamil Ugurbil, and Wei Chen. In vivo NAD assay reveals the intracellular NAD contents and redox state in healthy human brain and their age dependences Proceedings of the National Academy of Sciences 112, no. 9 (February 2015): 2876–81. https://doi.org/10.1073/pnas.1417921112.
- ^ Chen, D., J. Bruno, E. Easlon, S.-J. Lin, H.-L. Cheng, F. W. Alt, and L. Guarente. Tissue-specific regulation of SIRT1 by calorie restriction Genes & Development 22, no. 13 (July 2008): 1753–57. https://doi.org/10.1101/gad.1650608.
- ^ Mouchiroud, Laurent, Riekelt H. Houtkooper, Norman Moullan, Elena Katsyuba, Dongryeol Ryu, Carles Cantó, Adrienne Mottis, et al. The NADthplus/Sirtuin Pathway Modulates Longevity through Activation of Mitochondrial UPR and FOXO Signaling Cell 154, no. 2 (July 2013): 430–41. https://doi.org/10.1016/j.cell.2013.06.016.
- ^ Zhang, H., D. Ryu, Y. Wu, K. Gariani, X. Wang, P. Luan, D. DAmico, et al. NADthplus repletion improves mitochondrial and stem cell function and enhances life span in mice Science 352, no. 6292 (April 2016): 1436–43. https://doi.org/10.1126/science.aaf2693.
- ^ Gong, Bing, Yong Pan, Prashant Vempati, Wei Zhao, Lindsay Knable, Lap Ho, Jun Wang, et al. Nicotinamide riboside restores cognition through an upregulation of proliferator-activated receptor- coactivator 1 regulated -secretase 1 degradation and mitochondrial gene expression in Alzheimer s mouse models Neurobiology of Aging 34, no. 6 (June 2013): 1581–88. https://doi.org/10.1016/j.neurobiolaging.2012.12.005.
- ^ Long, Aaron N, Katrina Owens, Anna E Schlappal, Tibor Kristian, Paul S Fishman, and Rosemary A Schuh. Effect of nicotinamide mononucleotide on brain mitochondrial respiratory deficits in an Alzheimer’s disease-relevant murine model BMC Neurology 15, no. 1 (March 2015). https://doi.org/10.1186/s12883-015-0272-x.
- ^ Schultz, Michael B., and David A. Sinclair. Why NAD thplus Declines during Aging: It’s Destroyed Cell Metabolism 23, no. 6 (June 2016): 965–66. https://doi.org/10.1016/j.cmet.2016.05.022.
- ^ Ganeshan, Kirthana, and Ajay Chawla. Metabolic Regulation of Immune Responses Annual Review of Immunology 32, no. 1 (March 2014): 609–34. https://doi.org/10.1146/annurev-immunol-032713-120236.
- ^ Grube, K., and A. Burkle. Poly(ADP-ribose) polymerase activity in mononuclear leukocytes of 13 mammalian species correlates with species-specific life span. Proceedings of the National Academy of Sciences 89, no. 24 (December 1992): 11759–63. https://doi.org/10.1073/pnas.89.24.11759.
- ^ Beneke, S, R Alvarez-Gonzalez, and A Bürkle. Comparative characterisation of poly(ADP-ribose) polymerase-1 from two mammalian species with different life span Experimental Gerontology 35, no. 8 (October 2000): 989–1002. https://doi.org/10.1016/s0531-5565(00)00134-0.
- ^ Muiras, Marie-Laure, Marcus Müller, François Schächter, and A. Bürkle. Increased poly(ADP-ribose) polymerase activity in lymphoblastoid cell lines from centenarians Journal of Molecular Medicine 76, no. 5 (March 1998): 346–54. https://doi.org/10.1007/s001090050226.
- ^ Massudi, Hassina, Ross Grant, Nady Braidy, Jade Guest, Bruce Farnsworth, and Gilles J. Guillemin. Age-Associated Changes In Oxidative Stress and NADthplus Metabolism In Human Tissue PLoS ONE Edited by Michael Polymenis. 7, no. 7 (July 2012): e42357. https://doi.org/10.1371/journal.pone.0042357.
- ^ Fang, Evandro Fei, Morten Scheibye-Knudsen, Lear E. Brace, Henok Kassahun, Tanima SenGupta, Hilde Nilsen, James R. Mitchell, Deborah L. Croteau, and Vilhelm A. Bohr. Defective Mitophagy in XPA via PARP-1 Hyperactivation and NADthplus/SIRT1 Reduction Cell 157, no. 4 (May 2014): 882–96. https://doi.org/10.1016/j.cell.2014.03.026.
- ^ Fang, Evandro Fei, Henok Kassahun, Deborah L. Croteau, Morten Scheibye-Knudsen, Krisztina Marosi, Huiming Lu, Raghavendra A. Shamanna, et al. NAD thplus Replenishment Improves Lifespan and Healthspan in Ataxia Telangiectasia Models via Mitophagy and DNA Repair Cell Metabolism 24, no. 4 (October 2016): 566–81. https://doi.org/10.1016/j.cmet.2016.09.004.
- ^ Fang, Evandro Fei, Morten Scheibye-Knudsen, Katrin F. Chua, Mark P. Mattson, Deborah L. Croteau, and Vilhelm A. Bohr. Nuclear DNA damage signalling to mitochondria in ageing Nature Reviews Molecular Cell Biology 17, no. 5 (March 2016): 308–21. https://doi.org/10.1038/nrm.2016.14.
- ^ Kane, Alice E., and David A. Sinclair. Sirtuins and NAD thplus in the Development and Treatment of Metabolic and Cardiovascular Diseases Circulation Research 123, no. 7 (September 2018): 868–85. https://doi.org/10.1161/circresaha.118.312498.
- ^ Xu, Jing, Charlie W. Jackson, Nathalie Khoury, Iris Escobar, and Miguel A. Perez-Pinzon. Brain SIRT1 Mediates Metabolic Homeostasis and Neuroprotection Frontiers in Endocrinology 9 (November 2018). https://doi.org/10.3389/fendo.2018.00702.
- ^ Wallace, Douglas C. A Mitochondrial Paradigm of Metabolic and Degenerative Diseases, Aging, and Cancer: A Dawn for Evolutionary Medicine Annual Review of Genetics 39, no. 1 (December 2005): 359–407. https://doi.org/10.1146/annurev.genet.39.110304.095751.
- ^ Cantó, Carles, Lake Q. Jiang, Atul S. Deshmukh, Chikage Mataki, Agnes Coste, Marie Lagouge, Juleen R. Zierath, and Johan Auwerx. Interdependence of AMPK and SIRT1 for Metabolic Adaptation to Fasting and Exercise in Skeletal Muscle Cell Metabolism 11, no. 3 (March 2010): 213–19. https://doi.org/10.1016/j.cmet.2010.02.006.
- ^ Gomes, Ana P., Nathan L. Price, Alvin J.Y. Ling, Javid J. Moslehi, Magdalene K. Montgomery, Luis Rajman, James P. White, et al. Declining NADthplus Induces a Pseudohypoxic State Disrupting Nuclear-Mitochondrial Communication during Aging Cell 155, no. 7 (December 2013): 1624–38. https://doi.org/10.1016/j.cell.2013.11.037.
- ^ Nakahata, Y., S. Sahar, G. Astarita, M. Kaluzova, and P. Sassone-Corsi. Circadian Control of the NADthplus Salvage Pathway by CLOCK-SIRT1 Science 324, no. 5927 (March 2009): 654–57. https://doi.org/10.1126/science.1170803.
- ^ Ramsey, K. M., J. Yoshino, C. S. Brace, D. Abrassart, Y. Kobayashi, B. Marcheva, H.-K. Hong, et al. Circadian Clock Feedback Cycle Through NAMPT-Mediated NADthplus Biosynthesis Science 324, no. 5927 (March 2009): 651–54. https://doi.org/10.1126/science.1171641.
- ^ Nakahata, Yasukazu, Milota Kaluzova, Benedetto Grimaldi, Saurabh Sahar, Jun Hirayama, Danica Chen, Leonard P. Guarente, and Paolo Sassone-Corsi. The NADthplus-Dependent Deacetylase SIRT1 Modulates CLOCK-Mediated Chromatin Remodeling and Circadian Control Cell 134, no. 2 (July 2008): 329–40. https://doi.org/10.1016/j.cell.2008.07.002.
- ^ Chang, Hung-Chun, and Leonard Guarente. SIRT1 Mediates Central Circadian Control in the SCN by a Mechanism that Decays with Aging Cell 153, no. 7 (June 2013): 1448–60. https://doi.org/10.1016/j.cell.2013.05.027.
- ^ Spaans, Sebastiaan K., Ruud A. Weusthuis, John van der Oost, and Servà W. M. Kengen. NADPH-generating systems in bacteria and archaea Frontiers in Microbiology 6 (July 2015). https://doi.org/10.3389/fmicb.2015.00742.
- ^ Martens, Christopher R., Blair A. Denman, Melissa R. Mazzo, Michael L. Armstrong, Nichole Reisdorph, Matthew B. McQueen, Michel Chonchol, and Douglas R. Seals. Chronic nicotinamide riboside supplementation is well-tolerated and elevates NADthplus in healthy middle-aged and older adults Nature Communications 9, no. 1 (March 2018). https://doi.org/10.1038/s41467-018-03421-7.
- ^ Dellinger, Ryan W., Santiago Roel Santos, Mark Morris, Mal Evans, Dan Alminana, Leonard Guarente, and Eric Marcotulli. Repeat dose NRPT (nicotinamide riboside and pterostilbene) increases NADthplus levels in humans safely and sustainably: a randomized, double-blind, placebo-controlled study npj Aging and Mechanisms of Disease 3, no. 1 (November 2017). https://doi.org/10.1038/s41514-017-0016-9.
- ^ Baum, C L, J Selhub, and I H Rosenberg. The hydrolysis of nicotinamide adenine nucleotide by brush border membranes of rat intestine Biochemical Journal 204, no. 1 (April 1982): 203–7. https://doi.org/10.1042/bj2040203.
- ^ Roh, Eun, Jae Woo Park, Gil Myoung Kang, Chan Hee Lee, Hong Dugu, So Young Gil, Do Kyeong Song, et al. Exogenous nicotinamide adenine dinucleotide regulates energy metabolism via hypothalamic connexin 43 Metabolism 88 (November 2018): 51–60. https://doi.org/10.1016/j.metabol.2018.08.005.
- ^ Pillai, Vinodkumar B., Nagalingam R. Sundaresan, Gene Kim, Madhu Gupta, Senthilkumar B. Rajamohan, Jyothish B. Pillai, Sadhana Samant, P. V. Ravindra, Ayman Isbatan, and Mahesh P. Gupta. Exogenous NAD Blocks Cardiac Hypertrophic Response via Activation of the SIRT3-LKB1-AMP-activated Kinase Pathway Journal of Biological Chemistry 285, no. 5 (November 2009): 3133–44. https://doi.org/10.1074/jbc.m109.077271.
- ^ Pittelli, Maria, Roberta Felici, Vanessa Pitozzi, Lisa Giovannelli, Elisabetta Bigagli, Francesca Cialdai, Giovanni Romano, Flavio Moroni, and Alberto Chiarugi. Pharmacological Effects of Exogenous NAD on Mitochondrial Bioenergetics, DNA Repair, and Apoptosis Molecular Pharmacology 80, no. 6 (September 2011): 1136–46. https://doi.org/10.1124/mol.111.073916.
- ^ Grant, Ross, Jade Berg, Richard Mestayer, Nady Braidy, James Bennett, Susan Broom, and James Watson. A Pilot Study Investigating Changes in the Human Plasma and Urine NADthplus Metabolome During a 6 Hour Intravenous Infusion of NADthplus Frontiers in Aging Neuroscience 11 (September 2019). https://doi.org/10.3389/fnagi.2019.00257.
- ^ Liu, Ling, Xiaoyang Su, William J. Quinn, Sheng Hui, Kristin Krukenberg, David W. Frederick, Philip Redpath, et al. Quantitative Analysis of NAD Synthesis-Breakdown Fluxes Cell Metabolism 27, no. 5 (May 2018): 1067–80.e5. https://doi.org/10.1016/j.cmet.2018.03.018.
- ^ Rainer, M., E. Kraxberger, M. Haushofer, H. A. M. Mucke, and K. A. Jellinger. No evidence for cognitive improvement from oral nicotinamide adenine dinucleotide (NADH) in dementia Journal of Neural Transmission 107, no. 12 (December 2000): 1475–81. https://doi.org/10.1007/s007020070011.
- ^ Demarin, V., S. S. Podobnik, D. Storga-Tomic, and G. Kay. Treatment of Alzheimer’s disease with stabilized oral nicotinamide adenine dinucleotide: a randomized, double-blind study Drugs Exp Clin Res 30, no. 1 (2004): 27–33.






